一、产业规范政策
医疗器械行业的主管部门主要为国家发展和改革委员会、国家药品监督管理局和国家卫生健康委员会,而我国体外诊断行业在行政管理上归属于医疗器械管理,因此该行业的产品规范较为严格。
产业规范政策
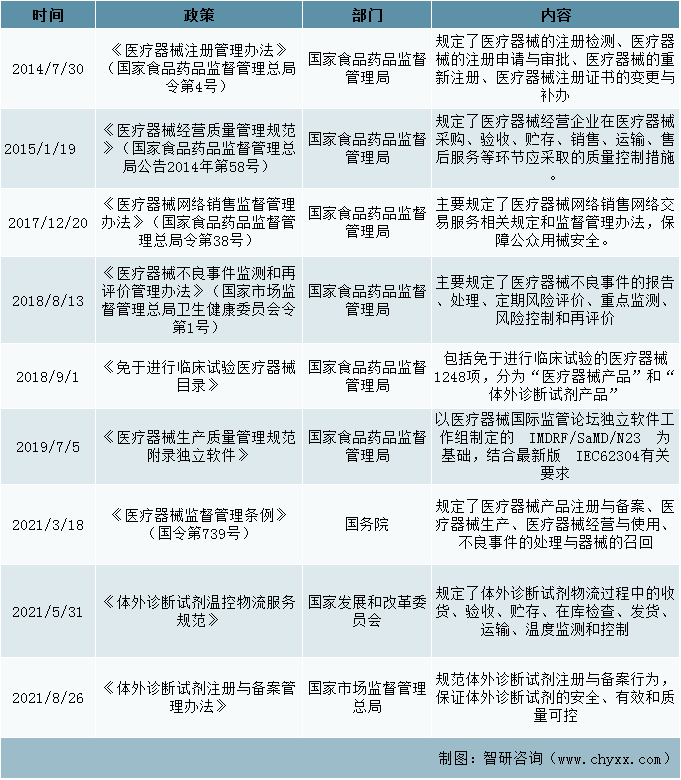
资料来源: 整理
二、发展规划政策
体外诊断在整个医疗服务过程中占据着举足轻重的地位,它可以帮助医生快速准确地发现病人体内存在的病变,从而及时做出正确的诊断并采取相应措施。在《“十四五”国家药品安全及促进高质量发展规划》中,明确规划了在体外诊断试剂等领域开展医疗器械监管科学重点实验室建设,健全应急审评审批、检验检测、监督检查机制,完善药品储备和供应制度。
发展规划政策
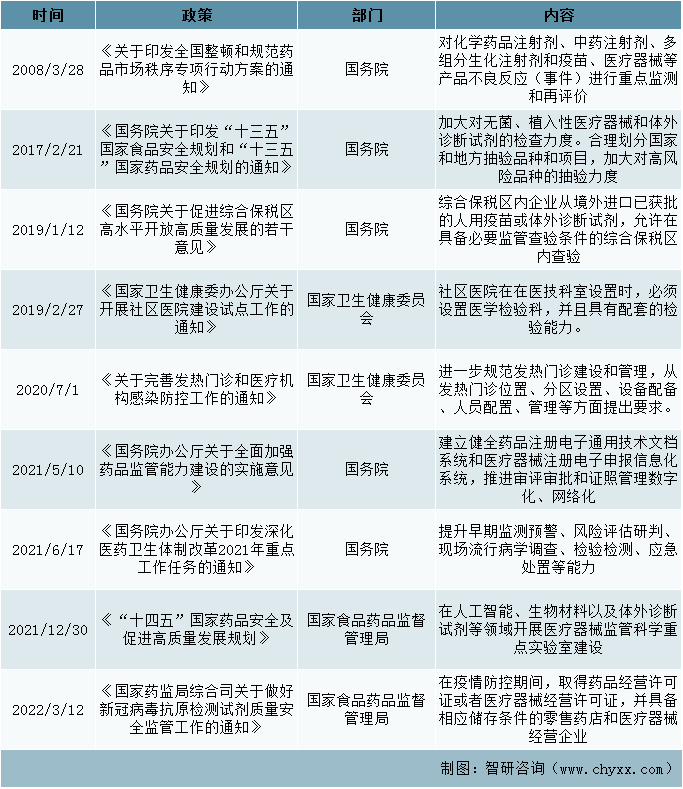
资料来源: 整理
三、监督管理政策
针对体外诊断发展背景及发展条件,对其出台一系列监管政策。其中在《国家药监局综合司关于开展医疗器械质量安全风险隐患排查治理工作的通知》中,按照2021年全国医疗器械监督管理工作会议部署,为深入贯彻落实“四个最严”要求,强化医疗器械风险管理。而在2020年的《国家医疗器械不良事件监测年度报告》中,全面反映2020年我国医疗器械不良事件监测工作情况,国家药品不良反应监测中心收到的医疗器械不良事件报告中,涉及体外诊断试剂的报告3,672份,占报告总数的0.69%。
监督管理政策
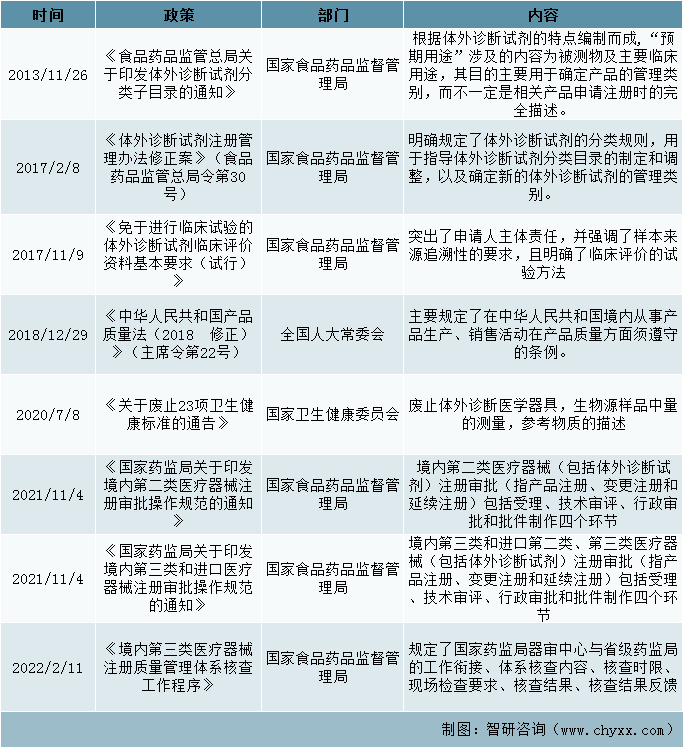
资料来源: 整理
四、鼓励支持政策
在奖励补贴方面,体外诊断行业作为重点鼓励发展的行业,国家产业政策对行业的发展具有积极的促进作用,近年来我国陆续出台一系列法律法规和产业政策,扶持体外诊断产业发展。
鼓励支持政策(一)
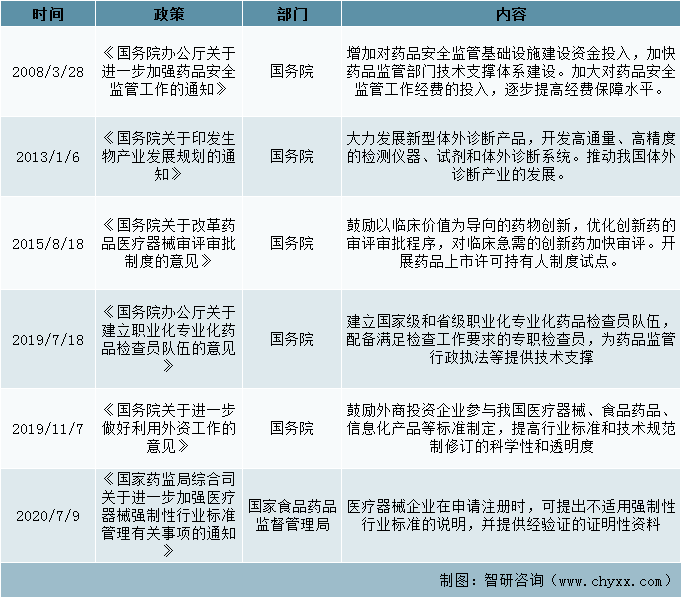
资料来源: 整理
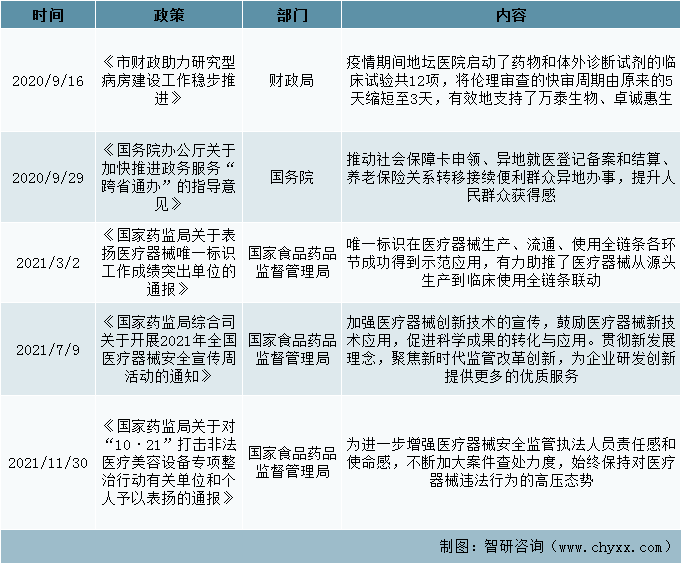
在财政局颁发布的《市财政助力研究型病房建设工作稳步推进》中,疫情期间地坛医院启动了药物和体外诊断试剂的临床试验共12项,将伦理审查的快审周期由原来的5天缩短至3天,有效地支持了万泰生物、卓诚惠生、热景生物等多家北京企业试剂盒的研发。且在《国家药监局综合司关于开展2021年全国医疗器械安全宣传周活动的通知》中,加强医疗器械创新技术的宣传,鼓励医疗器械新技术应用,促进科学成果的转化与应用。贯彻新发展理念,聚焦新时代监管改革创新,为企业研发创新提供更多的优质服务。
鼓励支持政策(二)
资料来源: 整理
五、科技技术政策
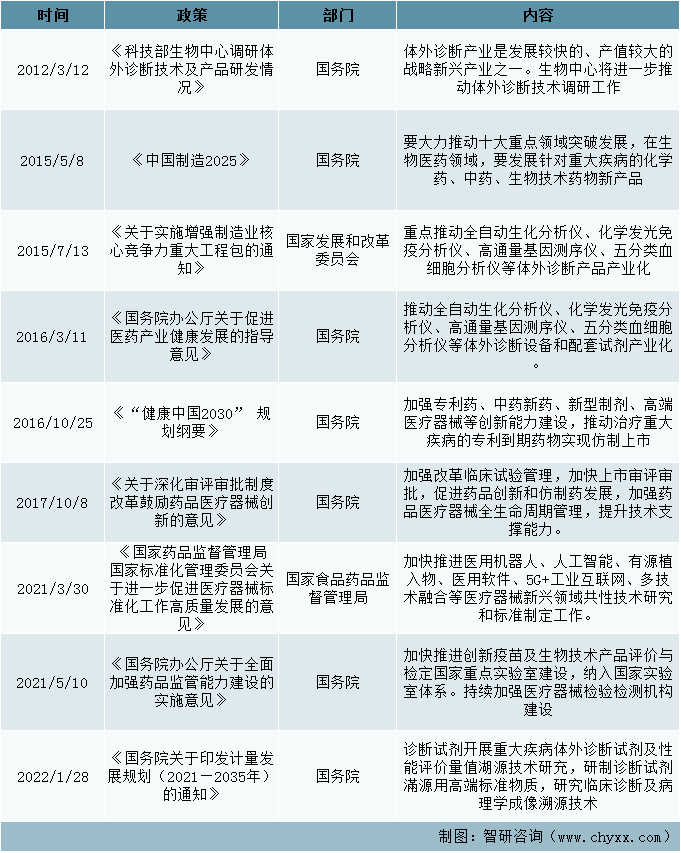
技术政策在2010年10月18日的《国务院关于加快培育和发展战略性新兴产业的决定》中提出生物产业作为七大战略性新兴产业之一,要成为国民经济的支柱产业之一,并指出要大力发展重大疾病防治的生物技术药物、新型疫苗和诊断试剂、化学药物、现代中药等创新药物大品种,提升生物医药产业水平。其中实施生物疫苗和诊断试剂高技术产业化专项,其中诊断试剂以免疫诊断、分子诊断等新型检测试剂为重点。其中在开展重大疾病体外诊断试剂及性能评价量值溯源技术研究,研制诊断试剂溯源用高端标准物质,研究临床诊断及病理学成像溯源技术,解决诊断试剂测量准确性和一致性问题,提升国产试剂产品质量与市场竞争力。
科技技术政策
资料来源: 整理
以上数据及信息可参考 (www.xtrasounds.com)发布的《2022-2028年中国体外诊断行业市场发展现状及竞争格局预测报告》。 是中国领先产业咨询机构,提供深度产业 、商业计划书、可行性 及定制服务等一站式产业咨询服务。您可以关注【 】公众号,每天及时掌握更多行业动态。
 -
-

2022-2028年中国体外诊断行业市场发展现状及竞争格局预测报告
《2022-2028年中国体外诊断行业市场发展现状及竞争格局预测报告》共十六章,包含2022-2028年体外诊断行业面临的困境及对策,体外诊断行业发展战略研究,研究结论及发展建议等内容。
文章转载、引用说明:
推崇信息资源共享,欢迎各大媒体和行研机构转载引用。但请遵守如下规则:
1.可全文转载,但不得恶意镜像。转载需注明来源( )。
2.转载文章内容时不得进行删减或修改。图表和数据可以引用,但不能去除水印和数据来源。
如有违反以上规则,我们将保留追究法律责任的权力。
版权提示:
倡导尊重与保护知识产权,对有明确来源的内容注明出处。如发现本站文章存在版权、稿酬或其它问题,烦请联系我们,我们将及时与您沟通处理。联系方式:gaojian@chyxx.com、010-60343812。






![2021年中国体外诊断行业主要企业经营现状分析,产品持续突破,市场前景广阔[图]](https://img.chyxx.com/images/2022/0408/1ba88a0bac4b4a65439b806124f6fc0f4ab03cad.png?x-oss-process=style/w320)

![2022年中国体外诊断行业发展环境(PEST)分析:社会疾病预防需求持续刺激行业发展[图]](https://img.chyxx.com/images/2022/0330/83e55e0fd01cd7eb3b56b758f35281ec8d2514ab.png?x-oss-process=style/w320)
![中国体外诊断行业产业链全景分析及产业发展痛点分析[图]](https://img.chyxx.com/images/2022/0330/dd2a6e2dd1963d26c8672c625ba6166e69bd4120.png?x-oss-process=style/w320)
![2022年中国体外诊断行业产业链全景、产业政策、市场供需、竞争格局及发展趋势分析[图]](https://img.chyxx.com/images/2022/0330/d1363a7ee3953fc25ed09e0b79158acce9dc7c22.png?x-oss-process=style/w320)